Cell子刊丨上海第九人民医院刘加强团队开发基因囊泡提高细胞内源性衣康酸治疗二型糖尿病
近日,上海第九人民医院刘加强教授团队在Cell子刊《Trends in Biotechnology》(中科院SCI分区1区, IF 14.9)发表了题为“Metabolic and immunomodulatory control of type 2 diabetes via generating cellular itaconate reservoirs by inflammatory-targeting gene-therapy nanovesicles”的研究著作。研究通过工程纳米囊泡靶向二型糖尿病中炎症巨噬细胞-NLRP3阳性巨噬细胞。纳米囊泡结合了巨噬细胞膜包被的普鲁士蓝纳米酶和增强衣康酸表达的基因片段。这种设计能够在免疫和代谢过程中发挥双重调节功能,并为解决糖尿病相关炎症和组织恢复提供了一种有前途的策略。

图1. 文献封面截图
研究背景
2型糖尿病(T2D)的发病机制与代谢器官中持续性低度炎症密切相关,这种被称为"代谢性炎症"(metabolic inflammation)的状态主要由巨噬细胞浸润和失调驱动。通过单细胞RNA测序分析,研究发现T2D患者的脂肪组织和肝脏中存在一种独特的NLRP3⁺炎性代谢激活巨噬细胞亚群,该亚群在肥胖个体中显著富集,并表现出双重病理特征:一方面高表达NLRP3炎性体组分及炎性因子(IL-1β、CCL3等),促进caspase-1活化和IL-1β/IL-18释放;另一方面呈现明显的代谢功能紊乱,包括线粒体氧化磷酸化(OXPHOS)能力下降、脂肪酸转运异常增强以及脂滴过度积累。这种免疫代谢耦合失调形成恶性循环,直接加剧胰岛素抵抗和组织损伤。
尽管代谢物衣康酸(itaconate)被证实可通过抑制NLRP3炎性体组装、调控脂肪酸β-氧化(作为"CoA sink")和恢复线粒体功能来打破上述循环,但其强极性和跨膜障碍导致直接给药效率极低。现有替代策略如酯化衍生物(如4-OI)无法完全复制衣康酸的多重生物功能,而传统基因递送系统(如脂质体)又面临靶向性不足等问题。这种技术瓶颈使得针对T2D炎症的精准治疗长期停滞在临床前阶段。
为解决上述空白,本研究开发了一种炎症靶向基因治疗纳米囊泡系统(Ma(PB@IRG1))。该系统由普鲁士蓝(PB)纳米粒包裹IRG1过表达质粒,并修饰巨噬细胞膜制成。
(1)靶向递送:巨噬细胞膜涂层使纳米囊泡能主动靶向炎症部位(如脂肪组织和肝脏),结合PB的抗氧化酶模拟功能(清除ROS、保护线粒体)。
(2)增强itaconate生产:通过递送IRG1基因片段,在细胞内生成itaconate“储备池”,绕过直接输送屏障,抑制NLRP3炎性体激活。
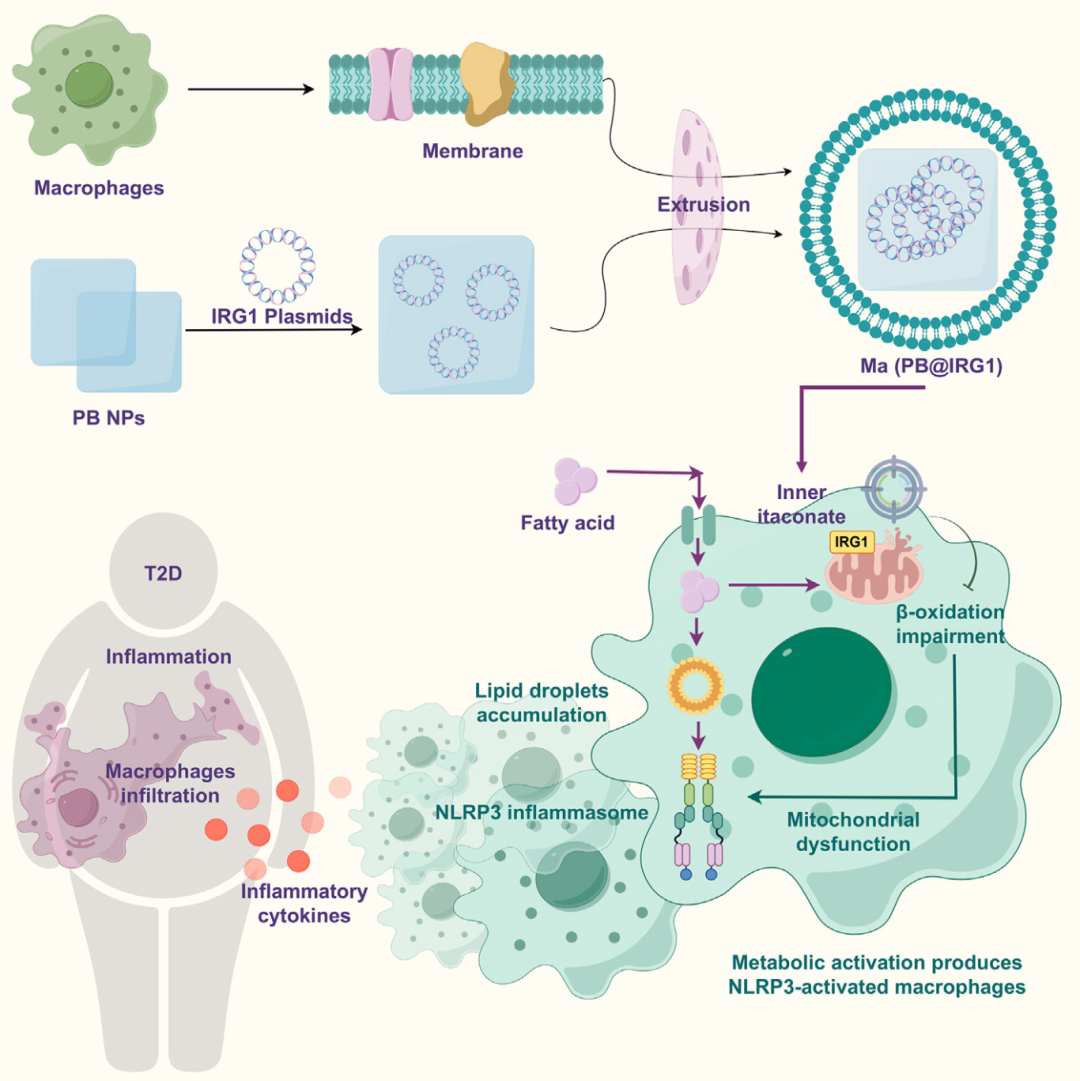
图2. 研究路线
研究材料与方法
本研究选用的小鼠原代巨噬细胞为终末分化型,对血清批次差异极度敏感。最终选用了赛业OriCell®提供的新西兰优级胎牛血清(货号FBSSR-01021)在提取小鼠原代巨噬细胞中批次稳定,效果优异,对于原代细胞来说是优秀的选择。
技术路线:
-
单细胞测序分析T2D人群脂肪组织NLRP3+巨噬细胞变化特征
-
构建炎症靶向基因治疗纳米囊泡系统(巨噬细胞膜包裹普鲁士蓝纳米酶及IRG1基因片段)
-
T2D小鼠治疗效果炎症
-
炎症小体抑制实验(NLRP3+巨噬细胞)
-
线粒体功能实验
-
脂肪酸代谢实验
研究结果
-
NLRP3+巨噬细胞代谢功能障碍与炎症有关
与正常组相比,巨噬细胞在糖尿病患者脂肪组织中比例大幅上调,表明巨噬细胞浸润在T2D过程中起关键作用(图A-B)。研究团队进一步将这些巨噬细胞和单核细胞亚群分为五个簇:Mac(01)簇,由标记物IL-1β、NLRP3和CCL3(IM)识别;Mac(02)簇,由标记物SPP1和TREM2(脂质相关巨噬细胞)鉴定;Mac(03)簇,由标记 C1QB和FOLR4(代谢调节的巨噬细胞)鉴定;Mac(04)簇,由标记FABP4、FABP5和CD36(血管周围巨噬细胞)鉴定;和Mac(05) 簇,由标记物HLA-DQB1和HLA-DQA1(单核细胞)鉴定。与其他簇相比,Mac(01)显示出更高的IL-1β、NLRP3和CCL3表达,表明 Mac(01)群体是巨噬细胞的主要导致T2D中AT炎症的亚群(图I,J)。研究团队分析了NLRP3+Mac(01)与其他簇之间的差异表达基因(DEGs)。通路富集分析表明,Mac(01)簇不仅富集了典型炎症途径,如MHC II类蛋白,表明单核细胞募集在糖尿病中的作用,而且显着富集了代谢和线粒体途径,包括“线粒体蛋白复合物”、“ATP 代谢过程”、“胆固醇代谢”、“脂滴(LD)”和“呼吸链复合物”(图P)。总的来说,这些结果表明,NLRP3+IL-1β+巨噬细胞与T2D致病背景下的代谢或线粒体相关功能障碍密切相关。
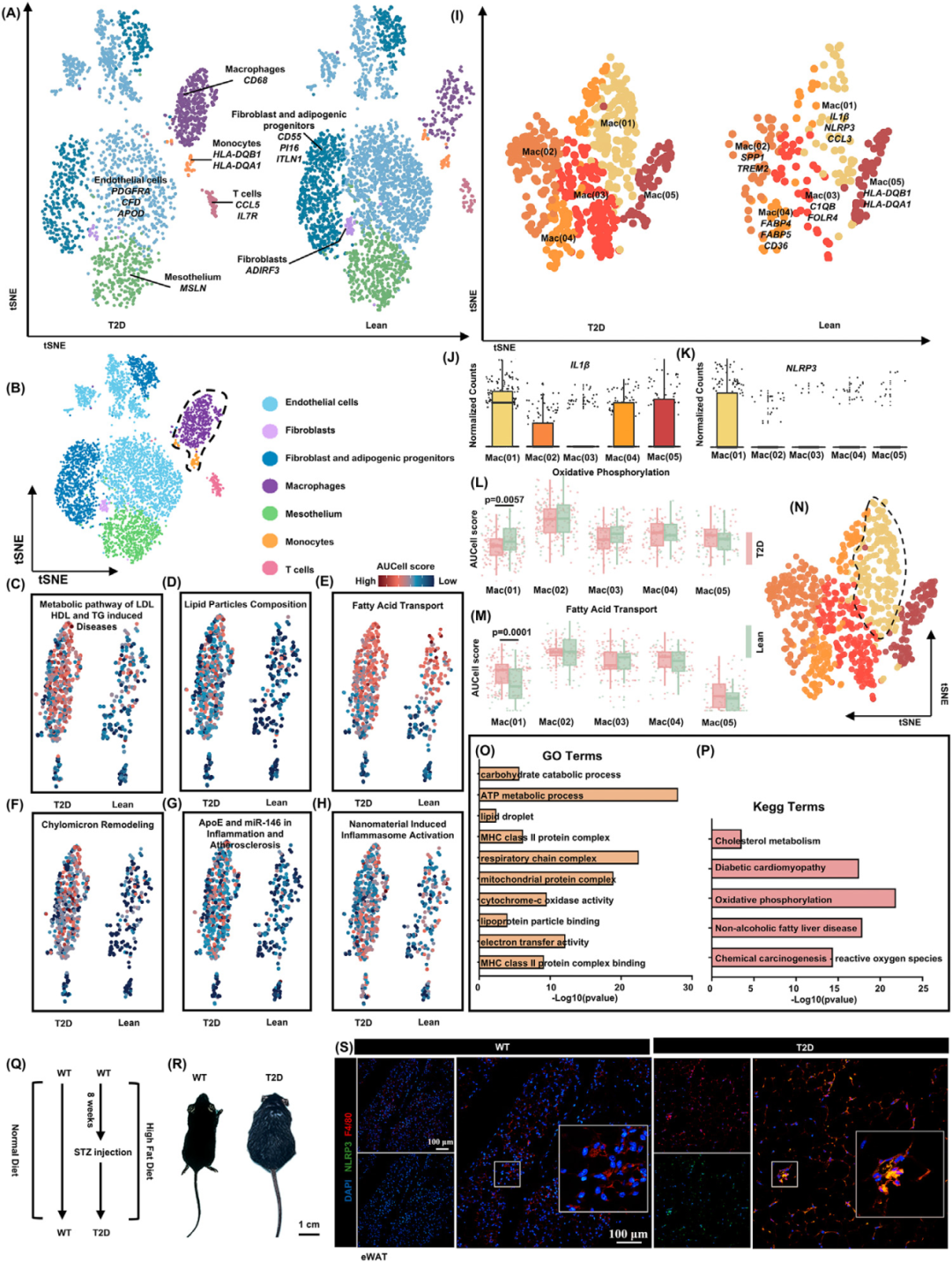
图3. NLRP3+巨噬细胞代谢功能障碍与炎症有关
-
纳米囊泡的合成与表征
与单独使用PB相比,涂有细胞膜的PB在透射电子显微镜(TEM)下表现出球形核壳结构,并且每个纳米囊泡都包裹在单层细胞膜中(图C)。纳米囊泡直径从60nm增加到70nm,与巨噬细胞膜双层的添加一致(图D)。此外,纯PB纳米囊泡也可能在消除过量的H2O2(图E)方面发挥关键作用,而基因片段加载不影响活性氧(ROS)的消除功效。
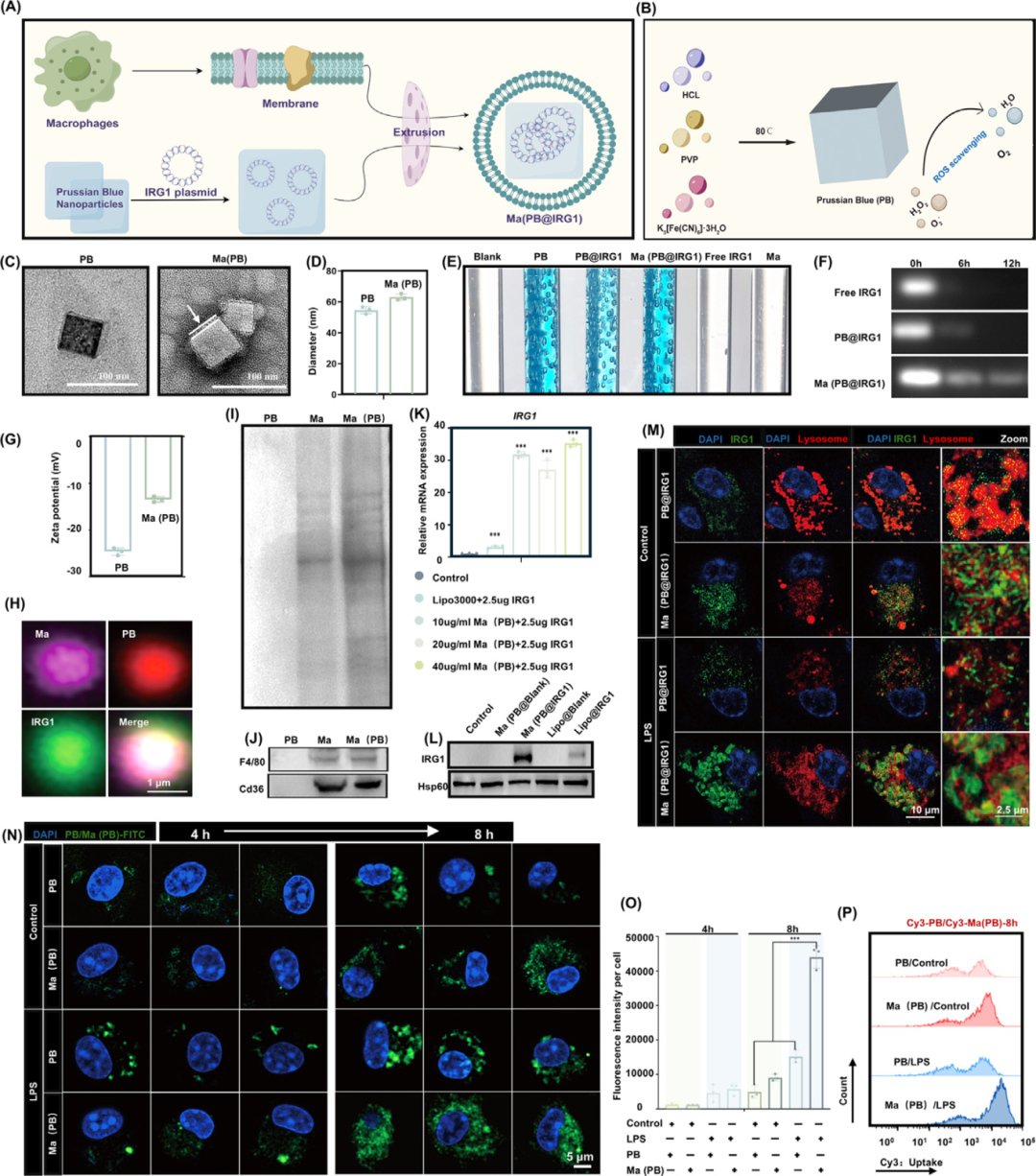
图4. 纳米囊泡的合成与表征
-
纳米囊泡在T2D小鼠模型中的治疗效果
研究团队通过建立高脂肪饮食(HFD)诱导的T2D小鼠模型评估了Ma(PB@IRG1)纳米囊泡的治疗效果。HFD诱导的T2D小鼠静脉注射Ma(PB@IRG1)纳米囊泡3周,以评估治疗对T2D相关炎症的影响(图A)。从第1周开始,Ma(PB@IRG1)治疗组小鼠的体重显示出显着变化(图B-C)。随后处死小鼠,解剖代谢器官eWAT,iWAT 和肝脏进行大小比较。与T2D组相比,Ma(PB@IRG1)组的所有三种组织的体积都较小(图D)。此外,Ma(PB@IRG1)组的血糖水平正常化至接近生理范围(图E),而高脂肪食物的膳食摄入量不受影响(图F)。Ma(PB@IRG1)治疗后,IL-1β和IL-18的血浆蛋白水平反映了全身炎症减少(图G-H),表明NLRP3炎症小体和炎症细胞因子释放受到抑制。
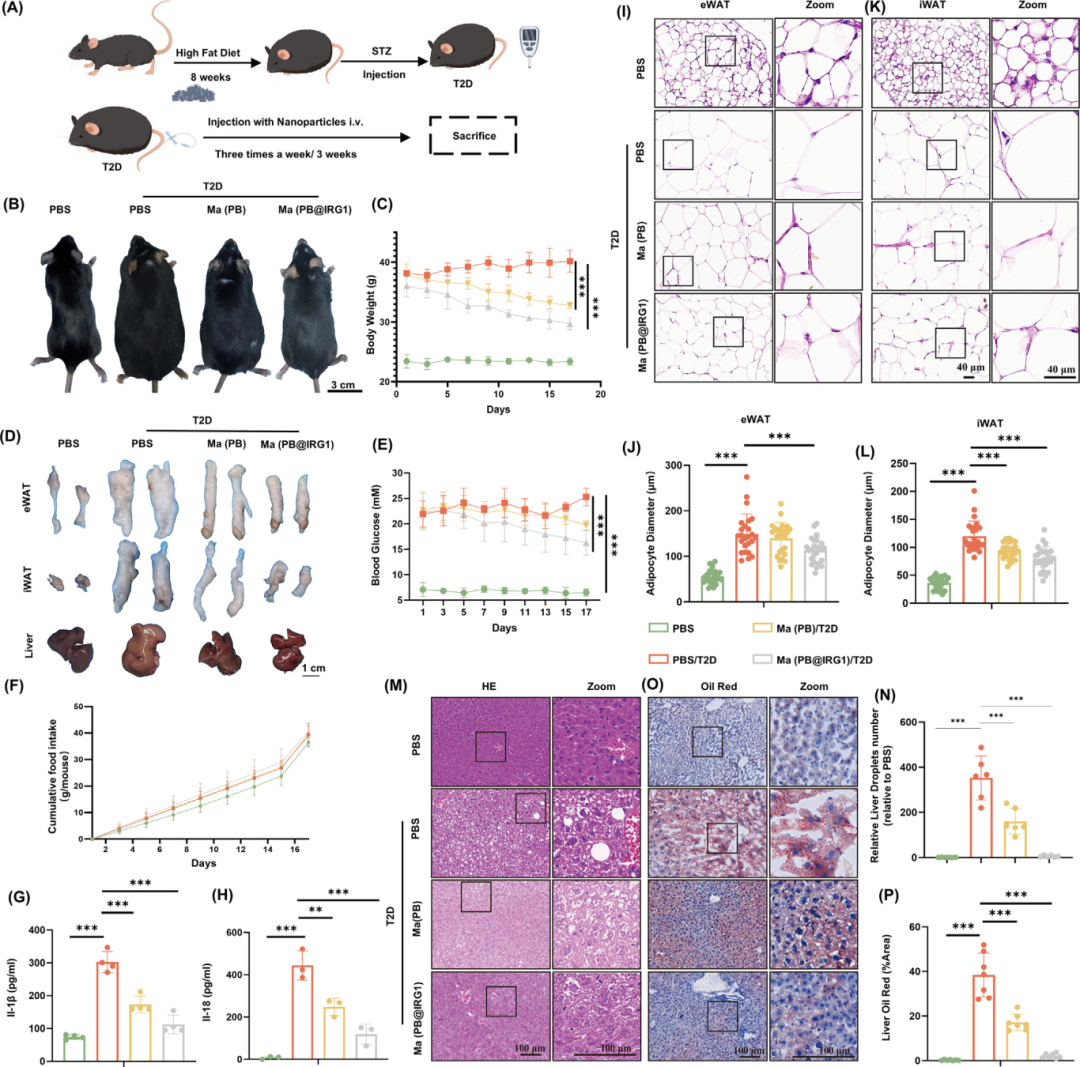
图5. 纳米囊泡在T2D 小鼠模型中的治疗效果
-
纳米囊泡调节NLRP3炎性小体激活和巨噬细胞极化程度
与lipo@IRG1(用脂质转染的BMDMs)或Ma(PB@Blank)(用空白质粒转染的BMDM作为对照)相比,Ma(PB@IRG1)转染完全抑制了IL-1β和IL-18释放到BMDM上清液中(图D-E)。此外,纳米囊泡似乎还减少了乳酸脱氢酶(LDH)的释放(图F)。上清液中caspase-1 p10(Casp-1 p10,caspase-1 的自动切割片段)的量也减少(图G),而IL-1β前体(pro-IL-1β)和caspase-1前体(Casp-1 p45)的表达仅受到轻微影响(图G)。此外,发现Ma(PB@IRG1)纳米囊泡对NLRP3蛋白水平有影响(图G)。这些结果表明Ma(PB@IRG1) 抑制NLRP3炎症小体激活。在NLRP3炎性小体激活过程中,含有CARD(ASC)的衔接蛋白凋亡相关斑点样蛋白被NLRP3募集并形成大的多聚体复合物,称为ASC斑点。Ma(PB@IRG1)抑制ASC斑点形成,如蛋白质印迹和共聚焦激光扫描所检测的那样(图H-I)。然而,细胞裂解物中ASC单体的表达没有受到影响(图H)。
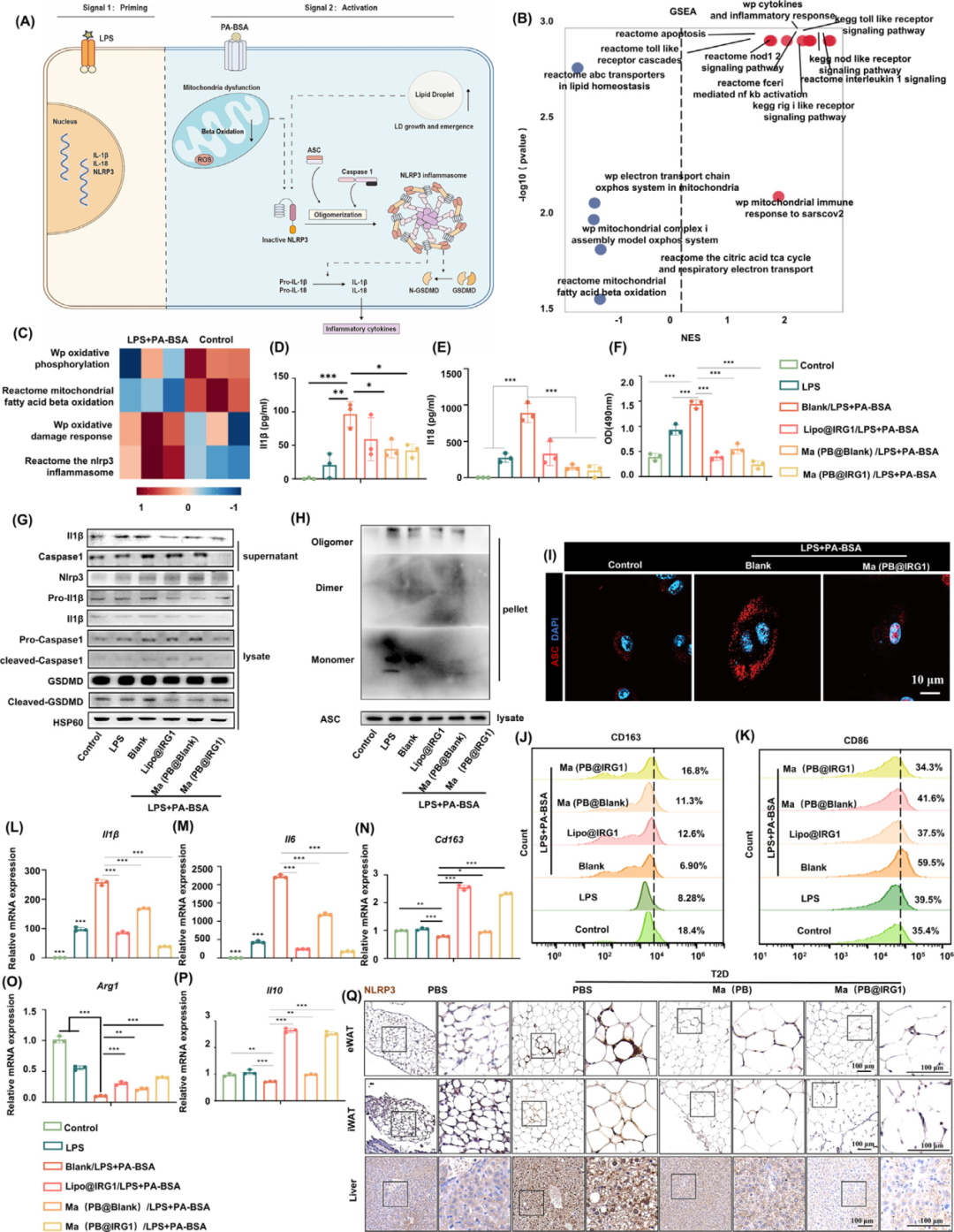
图6. 纳米囊泡调节NLRP3炎性小体激活和巨噬细胞极化程度
-
纳米囊泡恢复线粒体OXPHOS、形态和功能
OXPHOS已成为在这些代谢激活的炎症状态下失调的中枢代谢途径。基础呼吸测量显示,不同组的耗氧率(OCR)反映在OXPHOS的变化中,Ma(PB@IRG1)组增加,LPS+PA-BSA组显着降低,而ATP产生没有差异(图E-H)。这可能是由于衣康酸盐能够增强FA氧化,从而为OXPHOS提供更多的底物,并有助于线粒体功能的恢复。
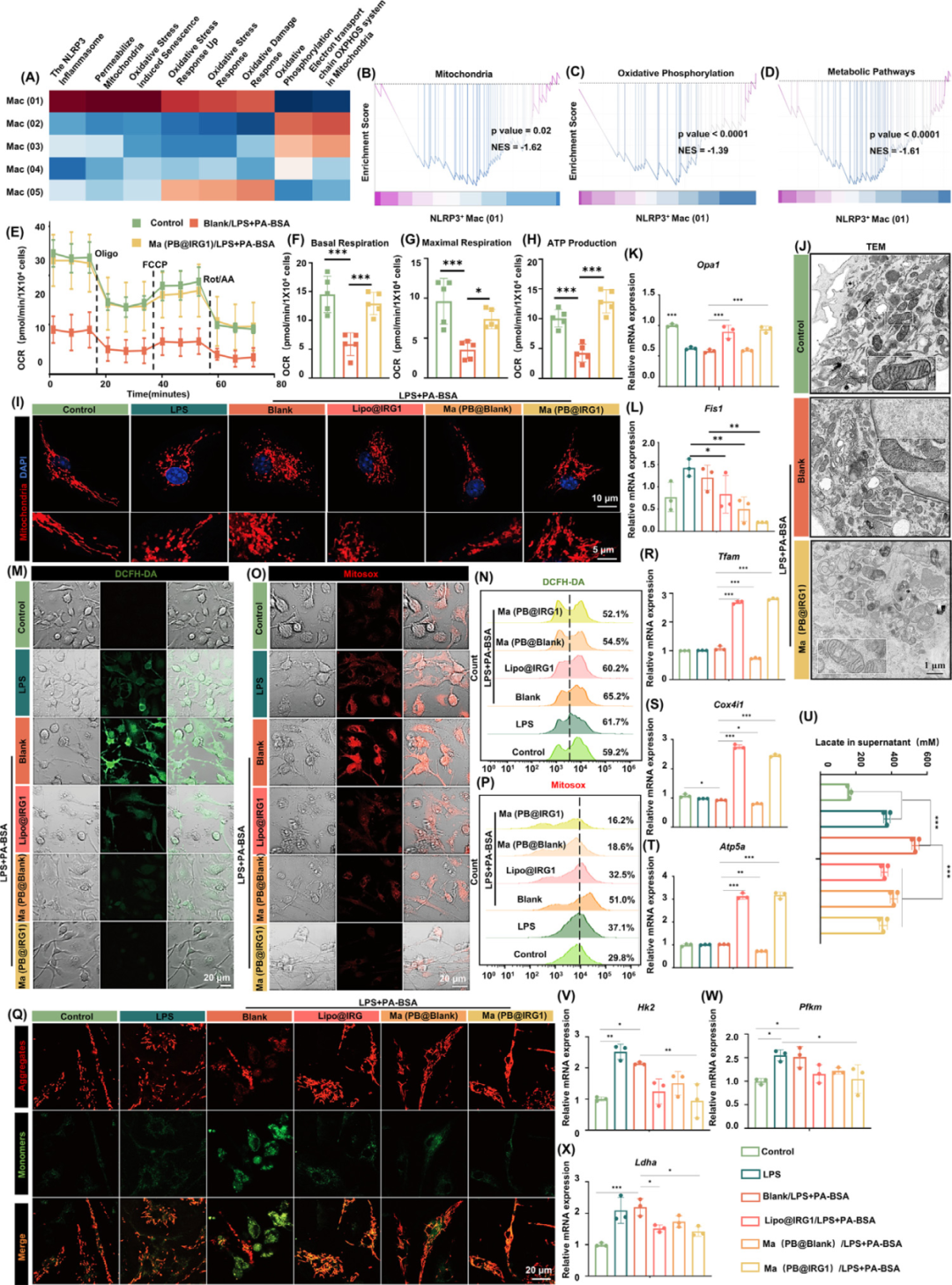
图7. 纳米囊泡恢复线粒体OXPHOS、形态和功能
-
纳米囊泡调节LD积累和线粒体β氧化
为了查明所涉及的特定代谢途径,研究团队使用荧光标记的PA-BSA (FITC-PA-BSA)跟踪细胞内FA。Ma(PB@IRG1)组显示出较少的 FA和FITC-PA-BSA与线粒体的强烈共定位(图I)。相比之下,LPS+PA-BSA组表现出较强的FITC-PA-BSA表达,出现环状信号并与尼罗河红染色的LD共定位(图J)。这些结果表明,代谢危险信号会导致FA积累,特别是以 LD 的形式。然而,影响FA代谢的确切途径仍不清楚。来自微环境的细胞外 FA 通过转运蛋白转运到细胞,如CD36、FABP和FA转运蛋白(FATP),然后通过长链酰基辅酶A合成酶(ACSL)转化为脂肪酰基辅酶A(FA-CoAs)。FA-CoAs可以储存在LD中,也可以通过肉碱棕榈酰转移酶1(CPT1)转运到线粒体中进行β氧化。所有过程都会影响LD的形成和FA代谢。尽管与Ma(PB@IRG1)组相比,LPS+PA-BSA组积累的LD更多,但其机制尚不清楚。qRT-PCR分析显示,Ma(PB@IRG1)调节FA摄取、氧化和 LD 形成,而FA转运基因,FABP4FATP1,在Ma(PB@IRG1)处理后略有下调(图K,L),参与脂质形成的基因(例如DGAT2和SOAT2)也是如此。相比之下,参与脂质生物发生的其他基因(如AGPAT4、PLPP1和GPAT3)的表达差异不显著。 然而,β氧化显着增加,这可能是IRG1过表达的结果(图M-U)。
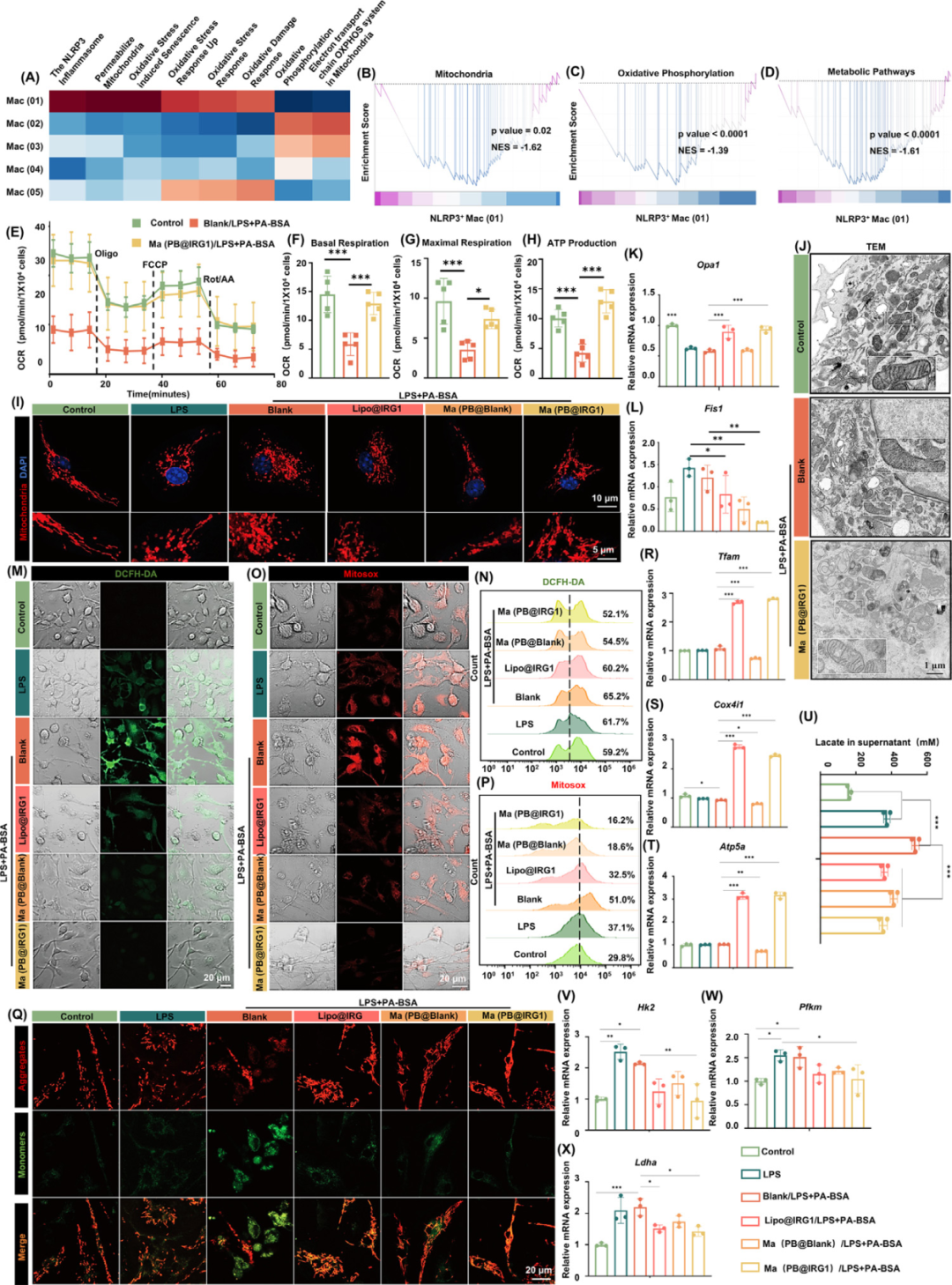
图8. 纳米囊泡调节LD积累和线粒体β氧化
研究团队开发了涂有巨噬细胞膜的IRG1过表达质粒负载纳米囊泡,以直接补充细胞衣康酸库。研究团队选择了与针对T2D微环境中代谢损伤的基因编辑工具共同递送的PB。PB已获得FDA批准,可模拟过氧化氢酶和超氧化物歧化酶活性,具有消除T2D微环境中过量ROS和调节线粒体功能的潜在治疗作用。巨噬细胞膜用作载体和靶向层。由于巨噬细胞上存在膜抗原,膜包被的纳米囊泡有效地靶向巨噬细胞,尤其是IM,并与多种促炎细胞因子和趋化因子结合。该研究提供了抑制T2D中的NLRP3炎症小体激活和代谢失衡的治疗平台。
原文检索:
[1] Lao, A., Li, W., Sun, Y., Cao, Y., Zhuang, Y., Wu, J., Li, D., Lin, K., Mao, J., & Liu, J. (2025). Metabolic and immunomodulatory control of type 2 diabetes via generating cellular itaconate reservoirs by inflammatory-targeting gene-therapy nanovesicles. Trends in biotechnology, S0167-7799(25)00310-5. Advance online publication. https://doi.org/10.1016/j.tibtech.2025.07.025
赛业OriCell®进口胎牛血清产品
胎牛血清是细胞培养中的重要一环,赛业OriCell®稳定供应合规进口的胎牛血清,并经过内部细胞库多种干细胞、原代细胞和细胞系培养测试,具有良好的促生长性能,可满足市面上绝大部分的细胞培养需求,提高实验结果一致性;基于自筛血清生产的配套培养基畅销十多年,助力科研人员各领域文章顺利发表。此外,我们还可稳定供应新生牛、成年牛及马血清,为科研人员提供多样选择。
填写需求描述给我们
工具快速咨询
400-680-8038
info@oricellbio.cn



