如果你的RAW264.7也在偷偷极化~教你1招重回“细胞年轻态”!
RAW264.7是小鼠来源的单核巨噬细胞系,广泛用于免疫学、炎症反应、肿瘤微环境及药物筛选研究。因其易于培养、转染效率高,名副其实成为实验室的“明星细胞”之一!
它脾气不算难搞,但稍不留神就给你整一出“炸毛”——今天贴壁贴得比502还牢,明天就突然化身“悬浮小气泡”;转染刚想秀操作,它却当场表演“集体躺平”。
别慌!今天咱们就把RAW264.7的正确打开方式再整理成一份“细胞极化防坑指南”,直接上干货!
01 RAW264.7细胞到底是什么形态的呢?
Tips:这些悬浮细胞仍保持生物学活性,在进行传代操作时应当予以保留,可通过250×g离心4min收集这些细胞,将获得的细胞沉淀重新悬浮后即可继续用于后续培养。

100×
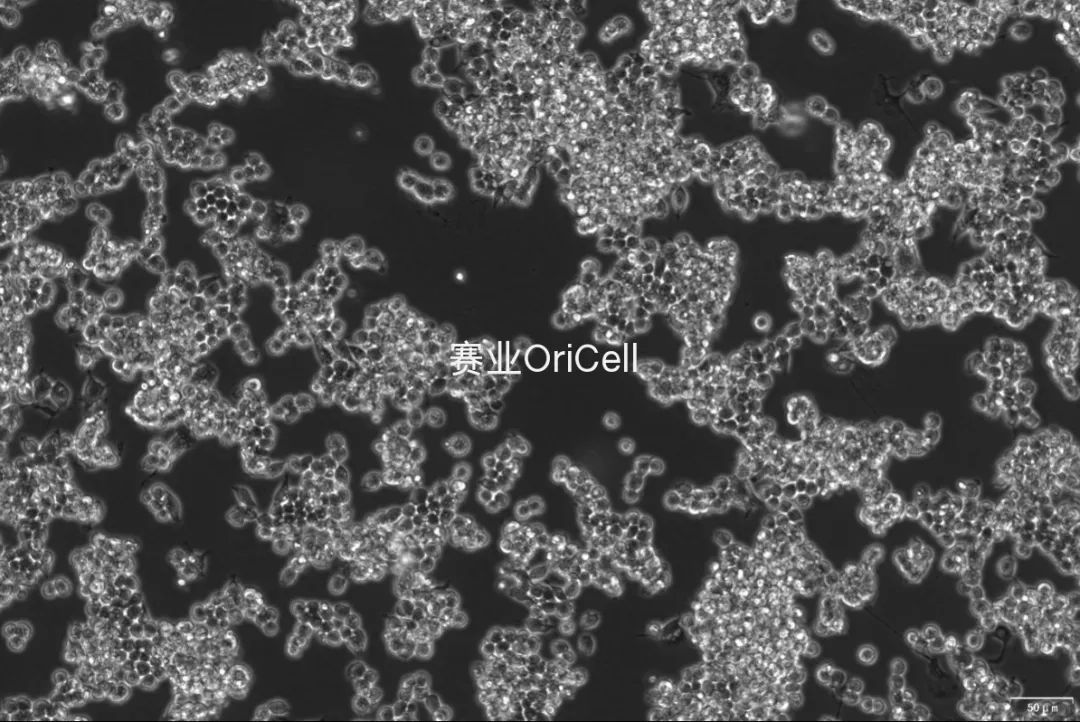
200×
RAW264.7镜下良好形态
02 RAW264.7细胞分化后的细胞形态是怎样的呢?
- 由贴壁不紧密的纺锤状细胞以及圆形/立方形细胞形态,转变为大而扁平的不规则多边形或多突触状且贴壁能力显著增强;
- 细胞边缘可见明显的丝状伪足;
- 胞质铺展面积增大,细胞出现扁平化。

40×
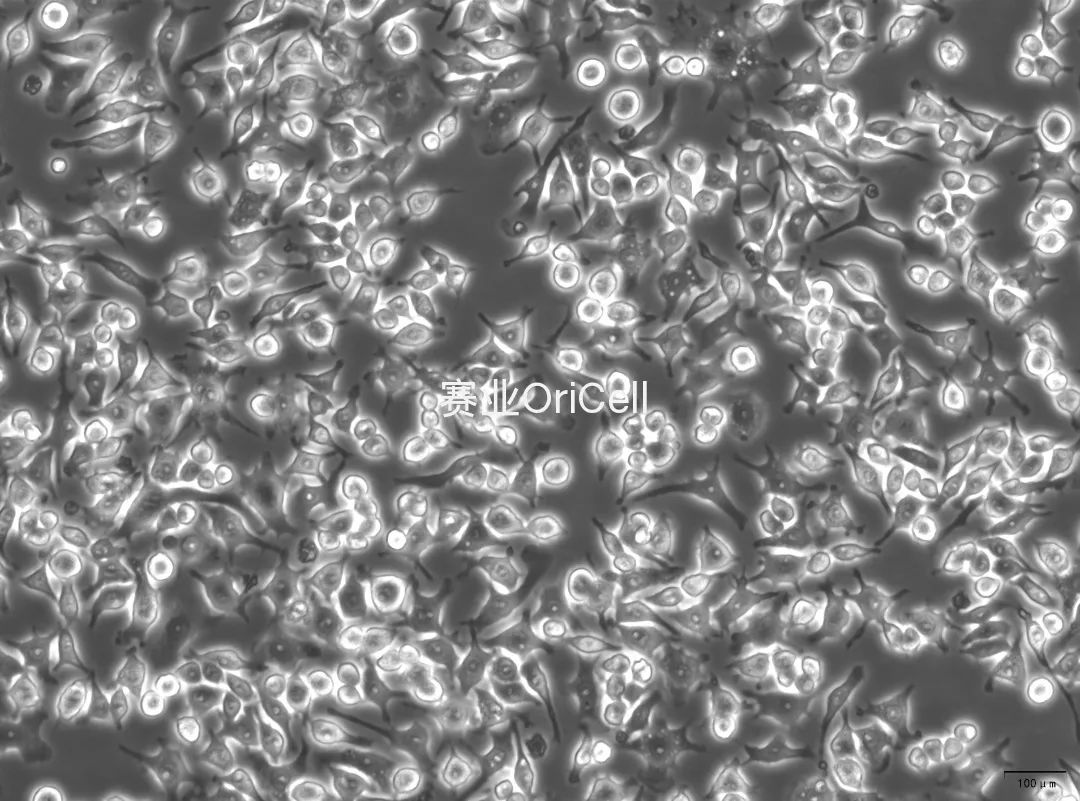
100×
RAW264.7镜下极化后形态
03 RAW264.7如何处理才能减少分化呢?
以下推荐“吹打法”具体操作:
-
传代时使用吸管或移液管吸弃细胞培养上清,留少许培养上清在细胞培养瓶或皿中,方便吹打即可。(如6cm培养皿加入2~3mL PBS)。
注意:若镜下观察有大量悬浮细胞存在,需将上清全部收集和吹打后的细胞一起离心,避免损失。
-
使用1mL一次性枪头或移液管吸取培养上清,直接吹打培养容器底面数次。
注意:吹打动作不可剧烈,避免产生大量气泡,可能损伤细胞,已分化且吹不下来的细胞果断丢弃。
-
将细胞悬液转移至15mL离心管中。
-
用PBS(6cm培养皿加入约3mL,10cm培养皿加入约6mL)洗涤培养容器1次,收集残留细胞。
-
收集的所有细胞悬液以250×g离心4min。
-
离心后去除上清。
-
15mL离心管中加入2mL完全培养基,轻柔吹打细胞沉淀,充分吹散、混匀。
-
将细胞按(4~6) ×104个活细胞/cm2接种至适宜的培养容器内。
-
摇匀细胞,放入37℃、5% CO2、饱和湿度的CO2培养箱中。
-
传代次日,观察细胞状态。若发现较多漂浮且状态不佳细胞,应予以换液。
-
每3天更换一次新鲜的培养基,待细胞汇合度至85%以上,即需传代或冻存。
Tips:建议使用培养皿进行RAW264.7细胞培养,推荐原因如下:
-
相较培养瓶来说,培养皿因物理空间和表面张力差异表现出更易吹打的特点;
-
培养皿的开放结构允许枪头低角度吹打,减少流体剪切力对贴壁较弱细胞的损伤。
填写需求描述给我们
工具快速咨询
400-680-8038
info@oricellbio.cn



