iMeta丨广西壮族自治区人民医院周磊/广西大学李一星组:解析HLF在代谢相关脂肪性肝病中的作用
近日,广西壮族自治区人民医院(广西医学科学院)周磊教授和广西大学动物科学技术学院李一星教授研究团队在《iMeta》期刊(IF 23.8)在线发表原创论著,揭示HLF/PPARα轴通过源自肠道微生物的细胞外囊泡调节代谢相关脂肪性肝病(MAFLD),为该疾病的治疗提供了新途径。

文献封面截图[1]
代谢相关脂肪性肝病(MAFLD)已成为全球第一大慢性肝病。随着肥胖和糖尿病等代谢性疾病在全球范围内的增加,MAFLD的患病率在普通人群中约为25%,在代谢异常患者中超过50%。尽管MAFLD的发病机制已被研究多年,但其复杂的分子机制仍未完全阐明。肠道微生物群在维持肠肝互作中发挥关键作用,肠道菌群失调和肠道屏障功能障碍与代谢相关脂肪性肝病(MAFLD)的发展密切相关。此外,细胞外囊泡(extracellular vesicles, EVs)作为细胞间通讯的重要媒介,携带多种生物活性分子,在脂肪组织、肝脏、骨骼肌和免疫细胞等组织中发挥重要作用。细菌源性的EVs或粪便EVs(fEVs)来源于肠道微生物,它们与真核细胞进行信息交流并调控其功能。通过生物技术手段对其进行调控有望为防治MAFLD提供有效途径。
HepG2、Caco-2、293T和原代细胞在含有10%优级胎牛血清(货号FBSSR-01021,赛业OriCell®)和1%青霉素-链霉素的培养基中培养;肠道特异性敲除小鼠、小鼠体成分分析、葡萄糖耐量试验(GTT)、胰岛素敏感性试验(ITT)等;研究运用了组织学分析、转录组测序、fEVs体内追踪等方法。
-
通过单细胞转录组测序和普通转录组测序,筛选出影响肠道脂质吸收的基因HLF。
-
构建肠道特异性敲除HLF小鼠验证表型。
-
通过转录组测序和分子实验筛选下游靶基因PPARα。
-
建立PPARα的抑制剂GW6471小鼠模型验证机制。
- 分离肠道微生物来源的细胞外囊泡,细胞和活体水平上验证机制。
图1. 肠道特异性敲除HLF对脂代谢的影响[1]
HLF是调节肠道脂质吸收的新靶点
研究团队选择健康的食蟹猴以及自发性代谢相关脂肪性肝病(MAFLD)食蟹猴,通过对食蟹猴肠道组织进行单细胞转录组测序(scRNA-seq)和普通转录组测序(RNA-seq),并结合细胞实验(使用赛业OriCell®优级胎牛血清培养)筛选和验证出HLF影响肠道脂质吸收(图2)。
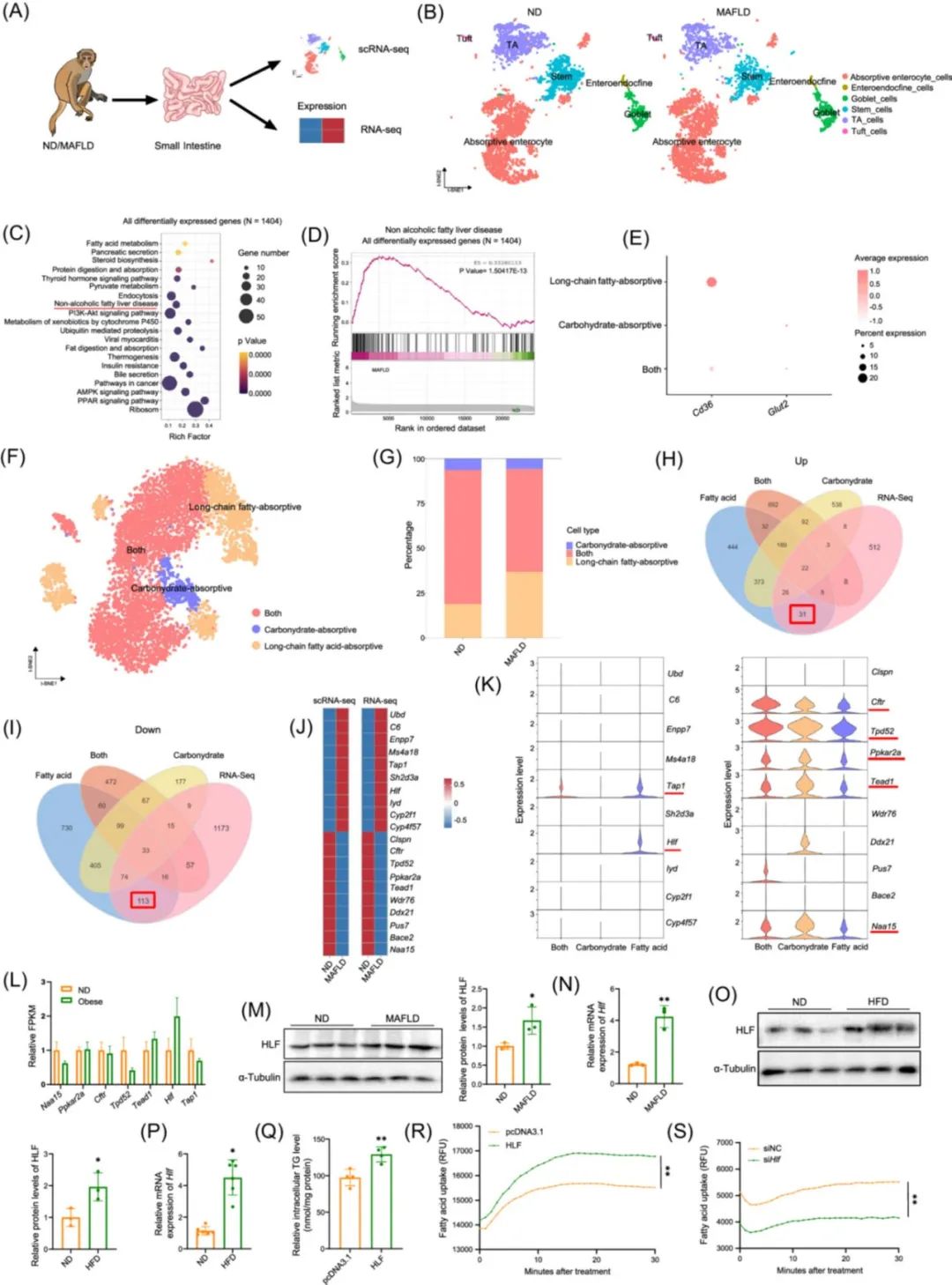
图2. 肝白血病因子(HLF)是调节肠道脂质吸收的新靶点[1]
HLF缺乏改善MAFLD
培育肠道特异性敲除Hlf基因杂合和纯合小鼠,探究肠道HLF在肝脏脂质代谢紊乱中的作用。结果表明,Hlf缺乏可能通过改善肠道屏障功能抑制外源性脂质的消化和吸收,进而改善MAFLD(图3)。
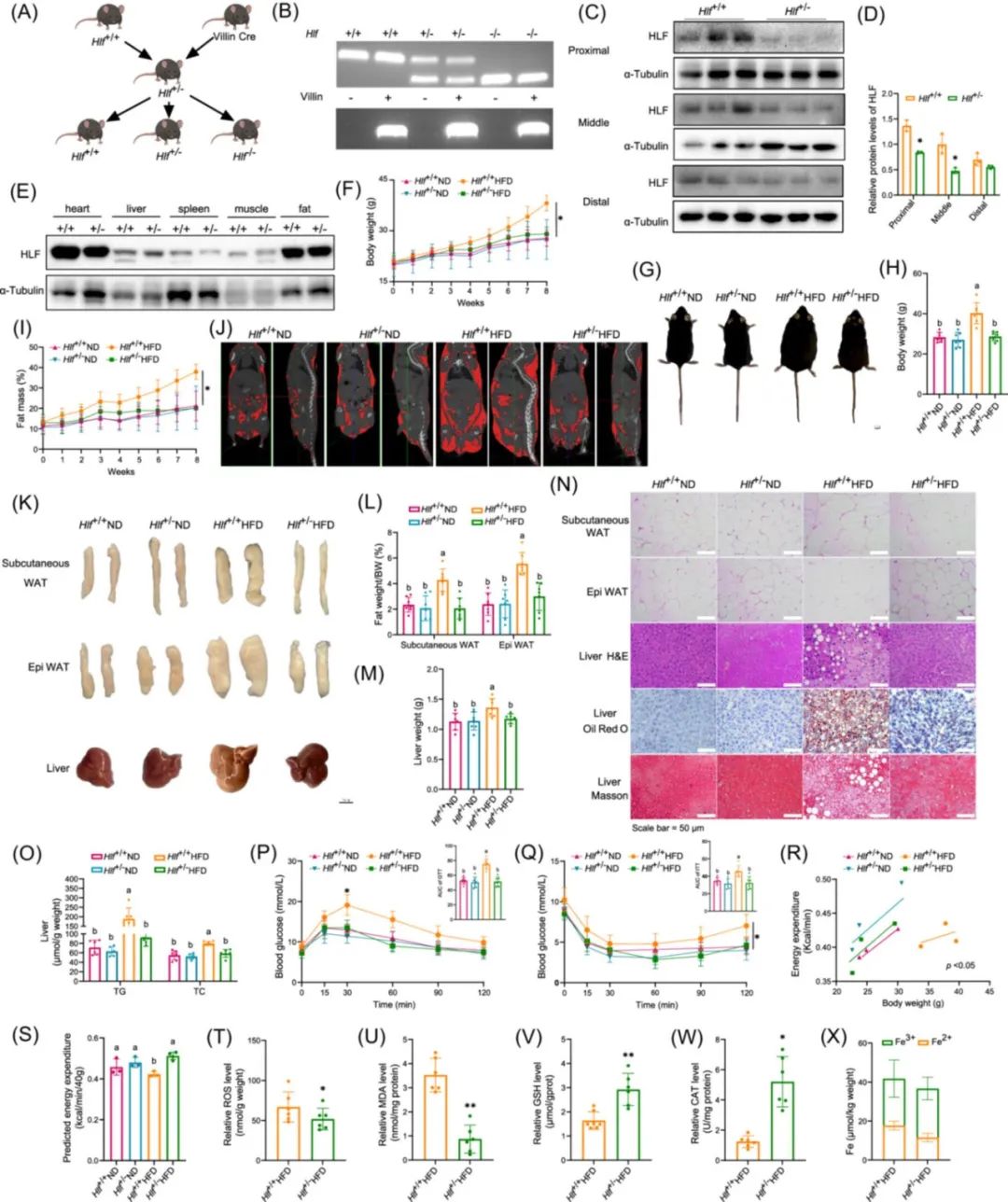
缺乏肝白血病因子(HLF)改善代谢相关脂肪性肝病(MAFLD)[1]
HLF调控Ppara的表达
为了进一步阐明HLF的作用机制,通过转录组测序和细胞实验(使用赛业OriCell®优级胎牛血清培养)筛选和验证,HLF通过调控PPARα影响肠道脂质代谢(图4)。
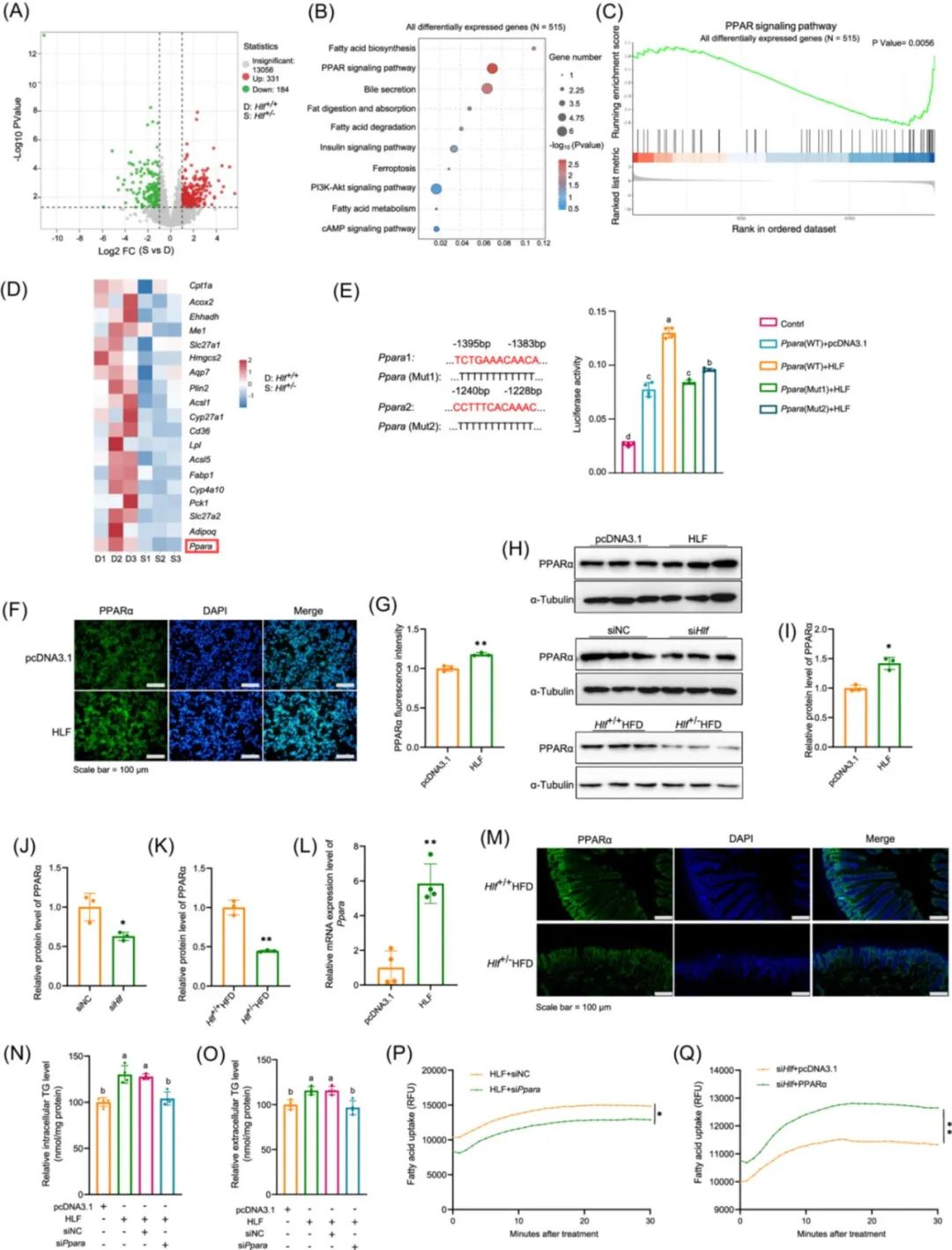
图4. 肝白血病因子(HLF)调节过氧化物酶体增殖物激活受体α(PPARα)表达[1]
抑制PPARα可以缓解MAFLD
为了探究PPARα是否参与HLF对MAFLD的调控,使用其抑制剂GW6471在活体水平进行研究(图5)。结果表明,HLF可能通过抑制PPARα来改善氧化应激和肠道菌群稳态进而缓解MAFLD。
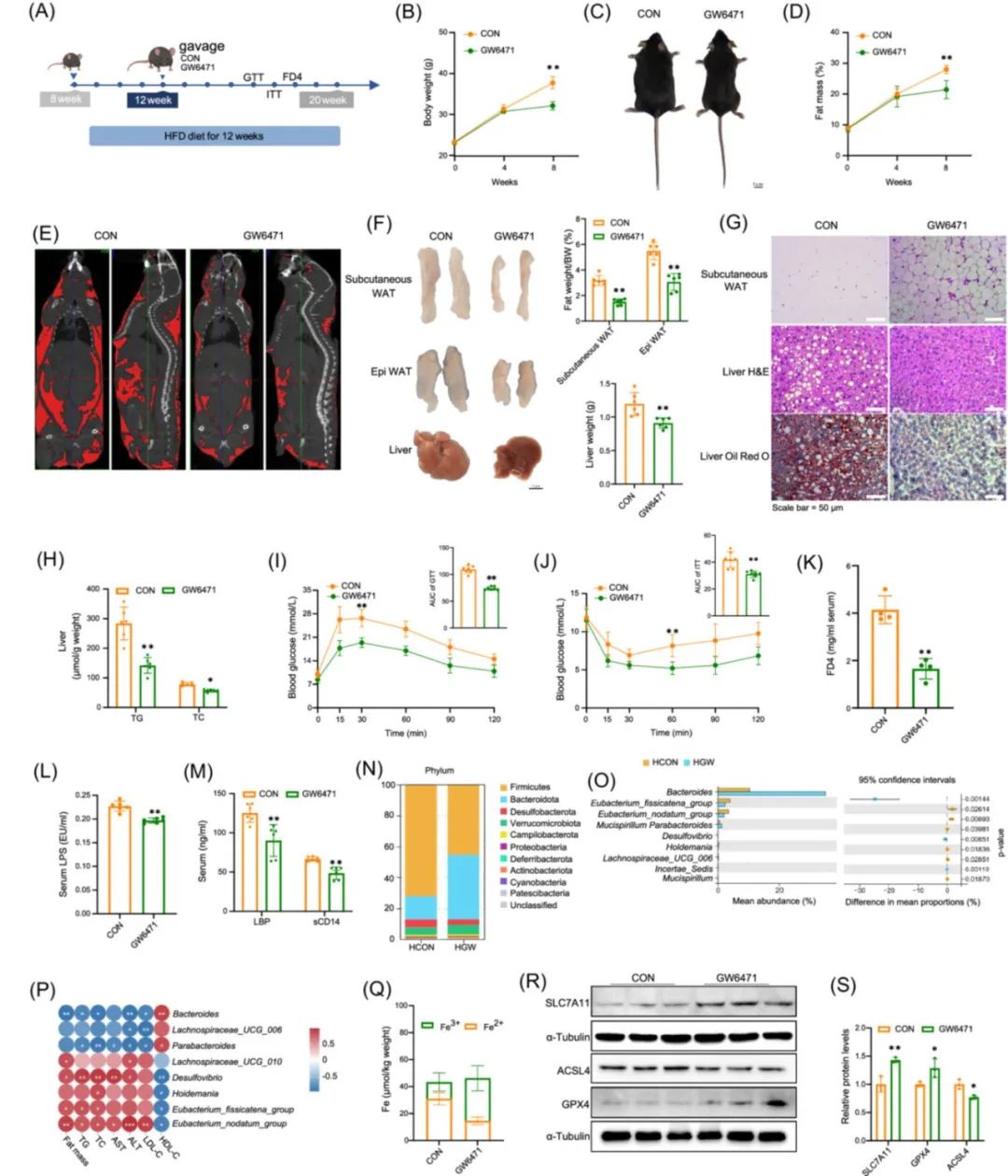
图5. 抑制过氧化物酶体增殖物激活受体α(PPARα)缓解代谢相关脂肪性肝病(MAFLD)[1]
HLF/PPARα轴通过肠道微生物来源细胞外囊泡(fEVs)调节脂质代谢亡
由于细胞外囊泡(EVs)在肠肝循环中起着关键作用,研究团队用GW6471处理小鼠,并从其肠道内容物中分离出肠道来源的细胞外囊泡(fEVs)。在细胞(使用赛业OriCell®优级胎牛血清培养)和活体水平上进行实验验证(图6)。结果表明,来自GW6471处理小鼠的fEVs通过改善肠道屏障功能和抑制铁死亡,缓解MAFLD。
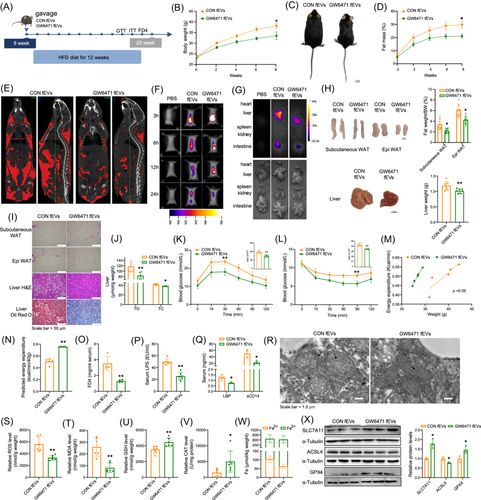
GW6471处理小鼠的肠道微生物来源的细胞外囊泡(fEVs)改善肠道通透性并抑制铁死亡[1]
fEVs中的脂质影响肝脂肪变性
通过脂质组学分析,研究了fEVs对肝脏脂质代谢的影响。实验表明,牛磺鹅脱氧胆酸(TCDCA)可降低细胞内氧化应激,并抑制铁死亡,证明其在fEVs介导的肝脏脂质代谢调控中发挥重要作用(图7)。
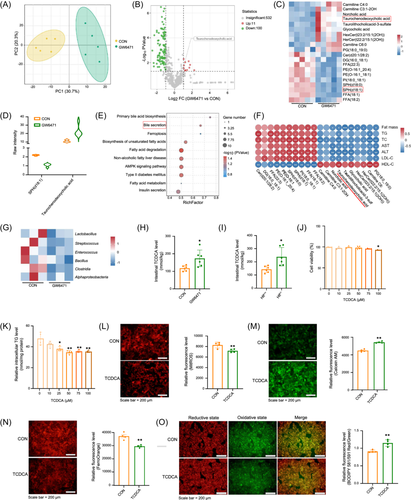
肠道微生物来源的细胞外囊泡(fEVs)中的脂质变化影响肝脏脂肪变性[1]
总之,该研究表明,HLF/PPARα轴通过肠道微生物来源的细胞外囊泡(fEVs)调节肠肝循环和抑制肝细胞铁死亡,从而改善MAFLD。结果显示,结合型胆汁酸TCDCA为fEVs降脂作用的关键分子。这些发现阐明了肠道HLF在调节MAFLD中的功能,并为治疗该疾病提供了新的途径。
原文检索:
[1] Xingzhen Yang, Jiale Wang, Xinyu Qi, Menglong Hou, Mengkuan Liu, Yixing Li, Lei Zhou, et al. 2025. HLF and PPARα axis regulates metabolic-associated fatty liver disease through extracellular vesicles derived from the intestinal microbiota. iMeta 4: e70022. https://doi.org/10.1002/imt2.70022
填写需求描述给我们
工具快速咨询
400-680-8038
info@oricellbio.cn



