Biofabrication丨生物3D打印领军企业诺普再生医学柯东旭团队研发新型3D打印生物活性支架,实现骨-血管协同再生
骨组织工程面临结构性支架设计的重要挑战,理想的支架需同时满足力学支撑与促进组织再生的双重需求。传统支架常因孔隙率不足、渗透性差及缺乏生物活性,导致细胞迁移受限、营养输送效率低,影响成骨与血管生成。如何通过优化微结构与表面特性协调机械性能和生物功能,成为该领域的关键问题。
生物3D打印领军企业诺普再生医学柯东旭团队于2025年6月在《Biofabrication》上(IF 8)发表研究“3D Printed Bioactive Coated Scaffolds Boost Osteogenesis and Angiogenesis via the Regulation of Scaffold Microstructure”,通过熔融挤出3D打印技术开发TCP-PCL复合支架,构建具有核壳结构的多孔载体。研究聚焦支架物理结构(孔隙率、渗透性)与化学修饰(NaOH-TCP涂层)对成骨分化和血管生成的协同调控机制,并结合理化性能测试、力学性能测试、体外降解测试、细胞实验和兔颅骨缺损模型进行系统性验证。

图1. 文献封面截图[1]
本研究通过3D打印技术制备不同孔隙结构(U300、O300、U600、O600)的PCL-TCP复合支架。使用NaOH和TCP进行表面修饰,分析理化性能、表面形貌、力学性能和降解行为。并通过孔隙率与流体渗透性分析支架结构对营养物质运输的影响。体外实验采用了成人骨髓间充质干细胞(hBMSCs由赛业OriCell®提供,货号HUXMA-01001)用于体外成骨分化实验,提供标准化的干细胞来源,并结合hBMSCs完全培养基(由赛业OriCell®提供,货号HUXMA-90011)和成骨诱导分化培养基(由赛业OriCell®提供,货号HUXMX-90021)维持细胞生长并定向诱导成骨分化。体外评价采用了细胞粘附、增殖(MTT法)、存活(live/dead染色)、成骨分化(ALP活性)、ARS染色(茜素红染色由赛业OriCell®提供,货号ALIR-10001)、RNA测序和qRT-PCR等方法,用于探究微结构与骨-血管协同再生的关系。
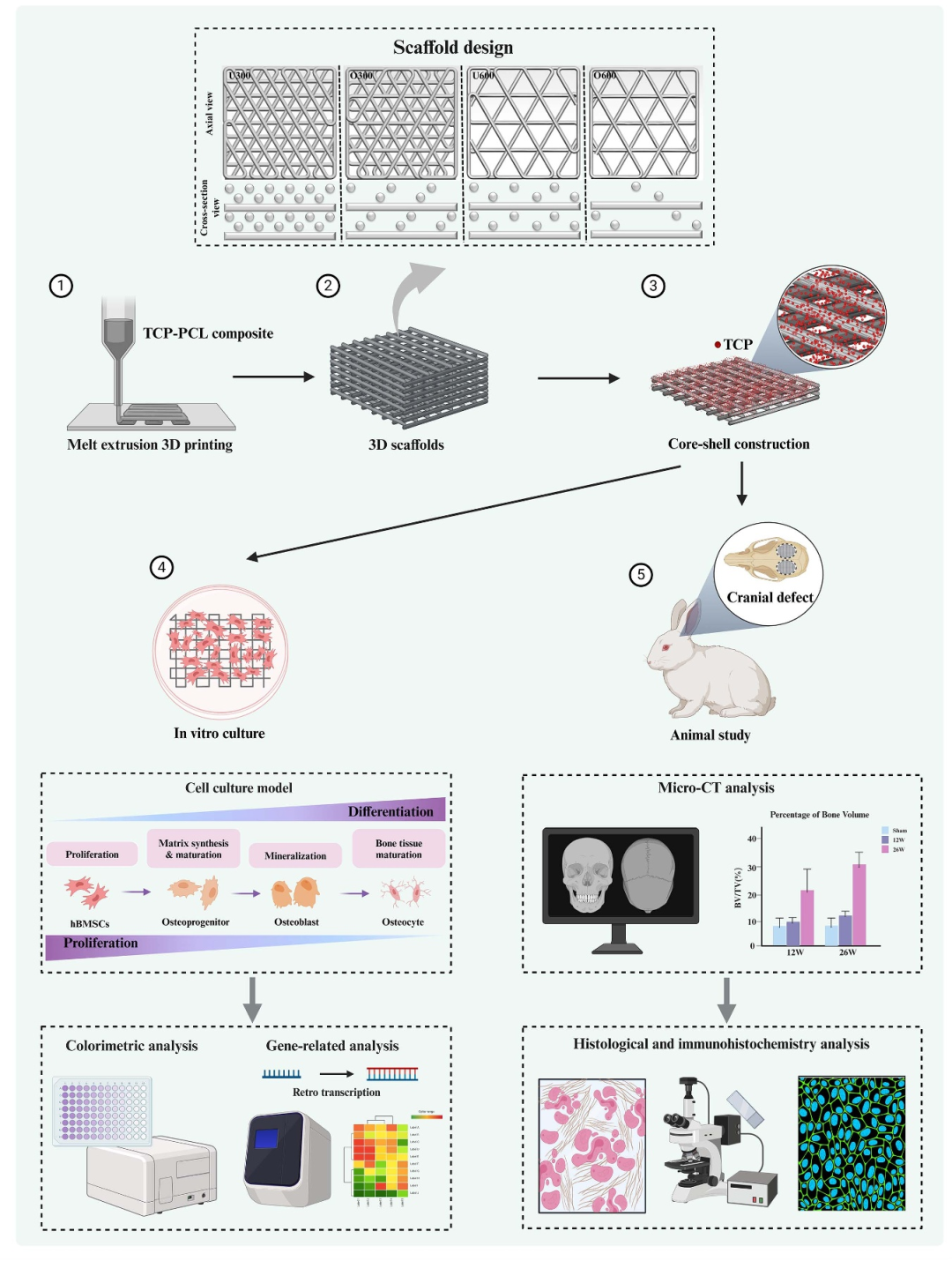
图2. 研究技术路线[1]
U600通过均匀层对齐设计,结合600μm孔隙与74.55%孔隙率,实现了渗透性、力学稳定性与细胞微环境的优化平衡。其参数接近骨修复的黄金窗口(孔隙率60-90%,孔隙尺寸400-800 μm),最终在体外成骨分化与体内骨再生中均表现出显著优势。
体外实验中,赛业OriCell®hBMSCs细胞及其培养和成骨分化培养基产品为研究的细胞模型建立和成骨分化评估提供了关键技术支持,通过其细胞来源的高度一致性与规范的细胞,培养SOP确保了实验数据的可靠性,并直接贡献于以下两大重要发现:
-
渗透性主导成骨分化:渗透性是成骨分化的关键因素。与U300支架相比,U600和O300组ALP活性与ARS矿化显著提高,同时成骨相关基因也得到了显著的上调。
-
孔隙率诱导血管生成:孔隙率较高的O300和U600支架显著促进血管生成相关基因,如VEGF的表达。
RNA测序揭示,孔隙率通过PI3K/AKT通路增强血管生成,而渗透性通过Wnt/β-catenin信号促进成骨分化。
孔隙率-渗透性协同调控通过Wnt-PI3K信号轴驱动骨再生,U600型支架兼具高效成骨与促血管生成能力,展示临床转化潜力。
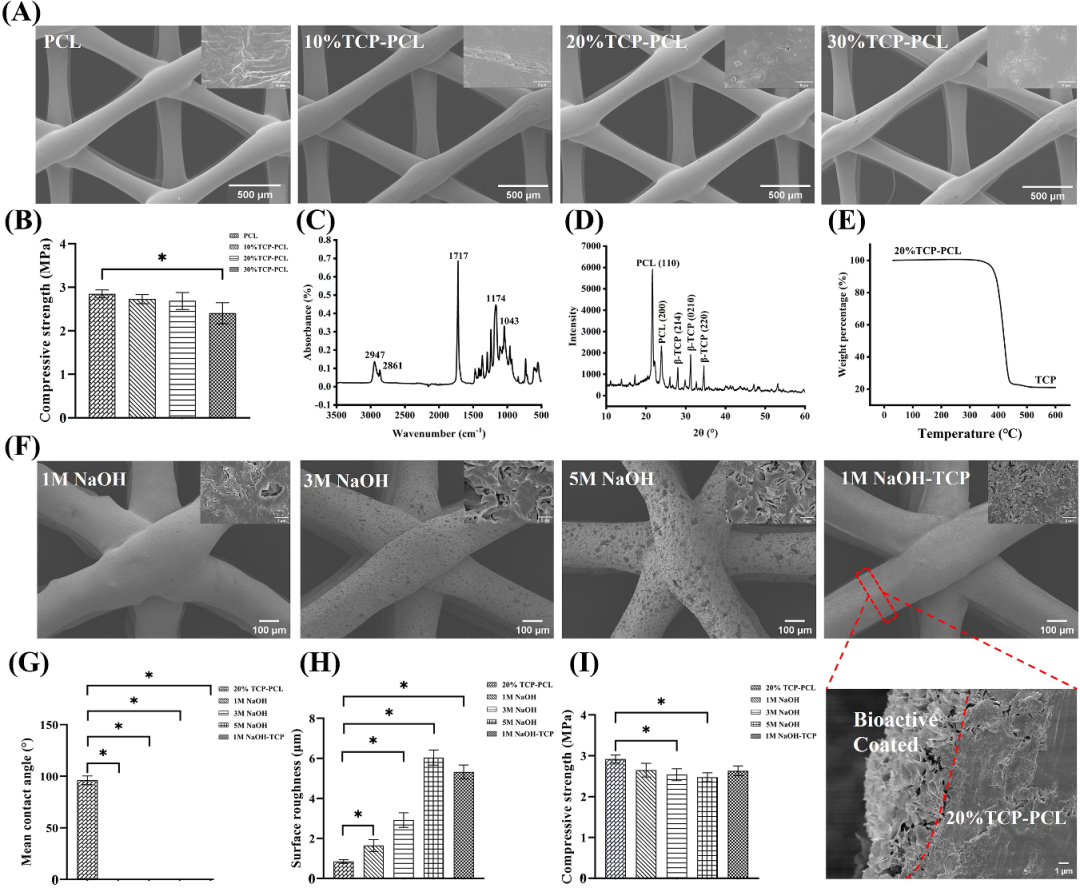
图3. SEM、抗压强度、FTIR、接触角、表面粗糙度等理化性能分析[1]
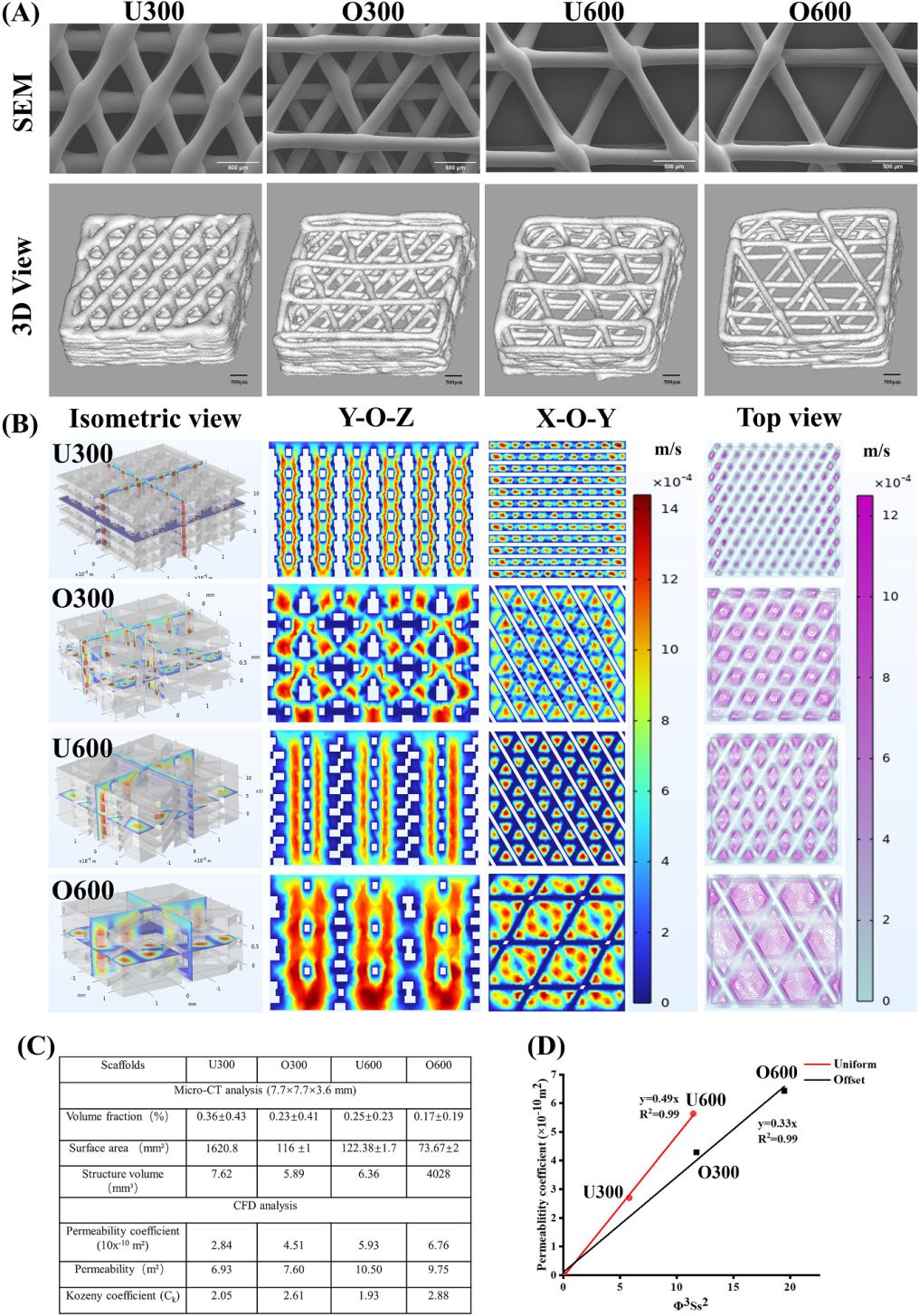
图4. SEM和Micro-CT图像、流线和速度轮廓、微CT和CFD分析,以及3D打印生物活性涂层支架的渗透系数[1]
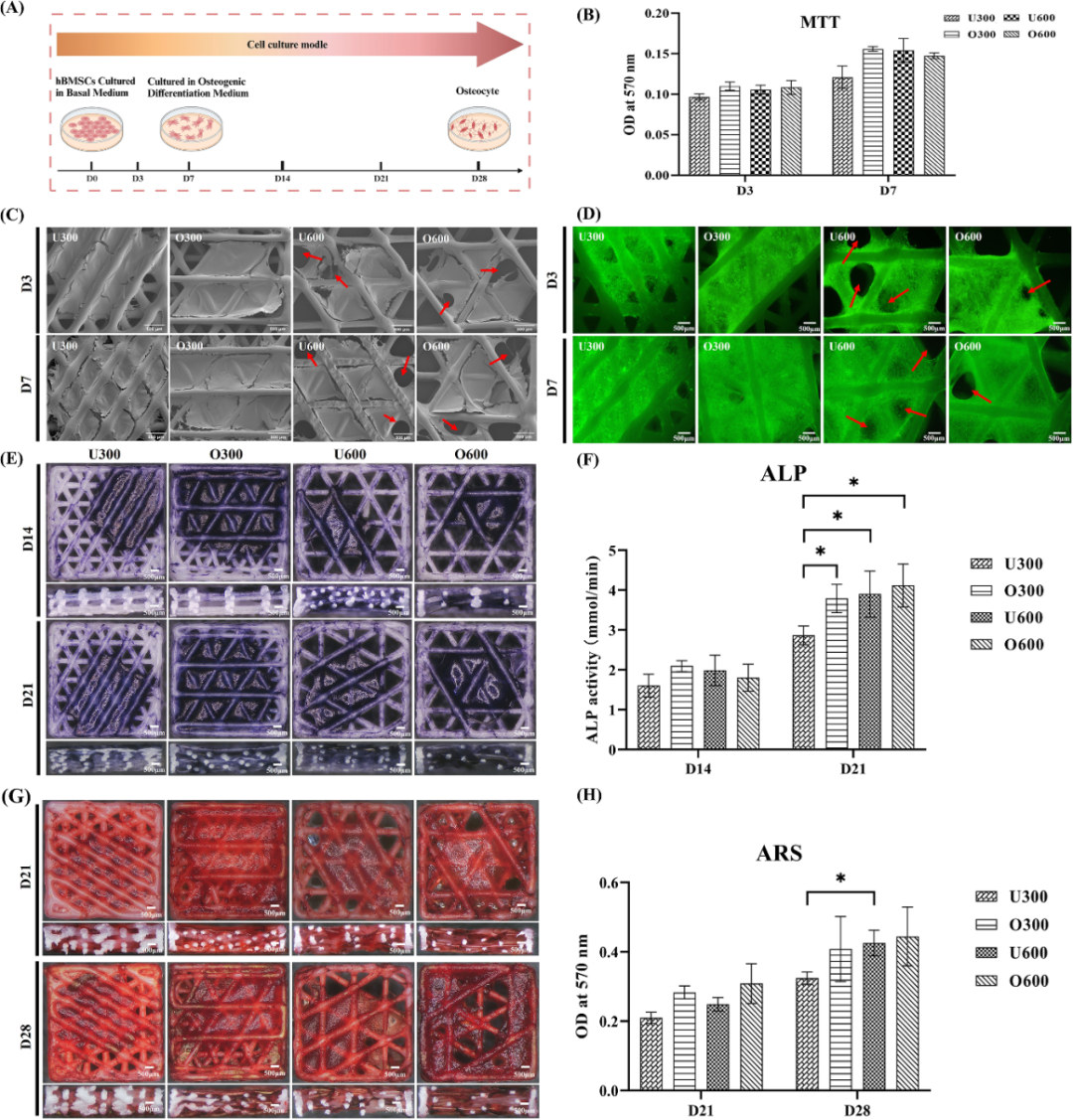
图5. 体外实验hBMSCs培养及MTT、ALP、ARS分析[1]
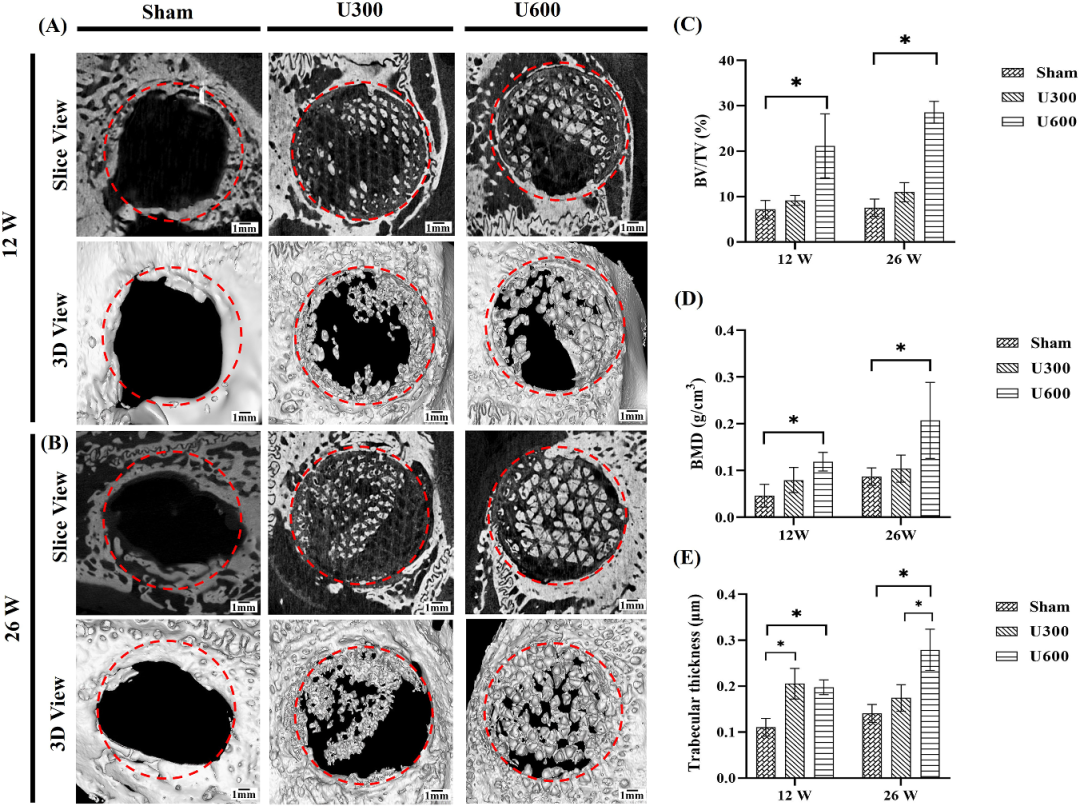
图6. 体内实验Micro-CT重建图像及修复效果[1]
本研究旨在探讨3D打印支架的化学/表面线索及物理/三维结构线索对体外和体内成骨与血管生成特性的影响及其潜在机制。首先,孔隙率与渗透性被确认为骨再生过程的关键调控因子,二者协同提升可显著促进成骨细胞增殖分化;当支架设计具备相似孔隙率时,渗透性成为主导晚期成骨分化的核心因素,从而提升体外与体内的成骨-血管生成效能。这种调控机制主要源自Wnt与PI3K/Akt信号通路的交互作用:渗透性优势强化Wnt信号轴,并显著上调BMP、IBSP、FZD5等基因表达,而孔隙率主要激活PI3K/Akt通路,进而调控IGF1、PI3K、VEGF等基因的表达。后续研究应基于大型动物模型探究这些支架在不同区域性骨缺损中长期成骨/血管生成效应,并评估其在长节段骨缺损修复中的临床应用潜力。
原文检索:
[1] Jiang Y, Zhou C, Yang X and Ke D 2025. 3D printed bioactive coated scaffolds boost osteogenesis and angiogenesis via the regulation of scaffold microstructure. Biofabrication. DOI 10.1088/1758-5090/addc9c
填写需求描述给我们
工具快速咨询
400-680-8038
info@oricellbio.cn



