软骨细胞实验特辑:如何原代分离提取软骨细胞
软骨组织由软骨细胞、基质及纤维构成。软骨组织再生能力强,这些增生的幼稚细胞形似纤维母细胞,以后逐渐变为软骨母细胞,并形成软骨基质,细胞被埋在软骨陷窝内而变为静止的软骨细胞。软骨细胞位于软骨陷窝内。
幼稚的软骨细胞位于软骨组织的表层,单个分布,体积较小,呈椭圆形,长轴与软骨表面平行,越向深层的软骨细胞体积之间增大呈圆形,细胞核圆形或卵圆形,染色浅,细胞质弱嗜碱性,常见数量不一的脂滴。
新生动物软骨细胞在提取时具有高活性、高提取效率、细胞质量好等优势,赛业OriCell®软骨细胞分离自软骨组织,采用胶原酶-中性蛋白酶联合消化的方法分离纯化获得。体外培养的软骨细胞对于研究其生理功能、药物作用以及各种致病因素作用下的病理生理改变具重要意义。本文就为大家重点介绍如何原代分离提取软骨细胞。
软骨细胞分离提取步骤
实验材料:乳鼠出生7d以内。
实验试剂:OriCell®软骨细胞完全培养基、OriCell®0.1% I型胶原蛋白酶、OriCell®0.25%中性蛋白酶、OriCell®PBS 100mL。
实验耗材:10cm培养皿、6cm培养皿、眼科镊(4把)、眼科剪(2把)、一次性吸管、无菌解剖盘。
实验步骤:
1. CO2窒息处死小鼠,75%酒精浸泡2-3 min。
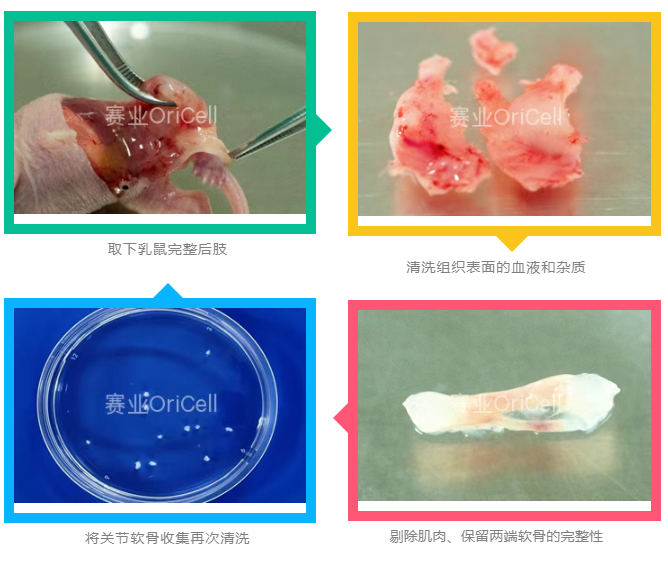
2. 在超净台内将小鼠的后肢完整取下,放入含有2%双抗的PBS培养皿中,清洗去除表面血液和杂质。
3. 使用干净的眼科镊和眼科剪将股骨和胫骨上的肌肉组织剔除,保留两端软骨的完整性。
4. 将关节处软骨从骨头上分离下来,将软骨上附着的肌肉和筋膜剔除干净。
5. 收集于6cm培养皿内,用眼科剪将组织剪碎至0.5mm³,太大酶解不彻底,太小损伤细胞。
6. 加入I型胶原酶和中性蛋白酶混合液,放入37℃培养箱内,消化6-8h,每隔1-2h取出培养皿,用一次性吸管吹打促进组织消化。
7. 消化结束后,用软骨完全培养基终止消化,进行离心。
8. 离心(300g、5min),弃上清,沉淀用PBS重悬再次离心,防止酶残留,影响细胞贴壁。
9. 细胞沉淀用软骨专用完全培养基重悬接种,将接种的培养皿放入37℃、5% CO2相对湿度的培养箱中培养。
10.次日观察细胞,是否有较多细胞碎片和死细胞,可以酌情考虑半量换液或全换液。
11.48h后细胞汇合度就能达到90%,细胞立体透亮、形态呈梭形、多角形,可以按照1:3的比例进行传代。
细胞形态:
培养条件优化Tips:使用高浓度血清的培养基(如10%胎牛血清+营养因子)进行细胞培养,有助于细胞的贴壁和增殖。
OriCell®软骨细胞完全培养基包含适合原代软骨细胞生长的基础培养基、OriCell®优级胎牛血清及细胞生长所需的其他添加物,可长期维持原代软骨细胞在体外良好的生长状态。
细胞检测(OriCell®软骨细胞质控要点):
1. 细胞鉴定:免疫荧光检测Collagen II为阳性>90%。
2. 通过细菌、真菌、支原体、内毒素检测。
3. 通过细胞复苏活力检测,复苏存活率>90%。

赛业OriCell®现货软骨细胞产品推荐
| 原代细胞现货及完培 | 货号 | 规格 |
| 大鼠膝软骨细胞 | RASKJ-02071 | 1×10∧6 |
| 大鼠膝软骨细胞完全培养基 | RASKJ-90011 | 500mL |
| 大鼠膝软骨细胞完全培养基 | RASKJ-80011 | 200mL |
| 大鼠肋软骨细胞 | RASRB-02071 | 1×10∧6 |
| 大鼠肋软骨细胞完全培养基 | RASRB-90011 | 500mL |
| 大鼠肋软骨细胞完全培养基 | RASRB-80011 | 200mL |
| 大鼠胸软骨细胞 | RASST-02071 | 1×10∧6 |
| 大鼠胸软骨细胞完全培养基 | RASST-90011 | 500mL |
| 大鼠胸软骨细胞完全培养基 | RASST-80011 | 200mL |
填写需求描述给我们
工具快速咨询
400-680-8038
info@oricellbio.cn



